|
Vinod Chandran, D.M., Ph. D.
Professeur agrégé de médecine, |

|
Cathy Flanagan, M.D., FRCPC
Professeure adjointe d’enseignement clinique, |
Introduction
Les spondylarthrites (SpA) sont courantes au Canada. On estime que 300 000 canadiens sont atteints de la spondylarthrite ankylosante (SA) et 300 000 de plus sont atteints de rhumatisme psoriasique (RP)1,2.
La prise en charge de ces deux affections a considérablement évolué depuis l’avènement des traitements dits biologiques. Les traitements anti-TNF ont démontré leur efficacité et innocuité dans le traitement de la SA et du RP, cinq agents différents ayant été approuvés pour ces indications au Canada (Tableau 1).

D’autres agents biologiques présentant un mécanisme d’action différent sont également venus enrichir l’arsenal thérapeutique. Par exemple, l’ustékinumab, un inhibiteur de la sous-unité p40 de l’IL-12/23, est indiqué dans le traitement du RP, tout comme l’abatacept, un modulateur de costimulation sélectif. Les inhibiteurs de l’IL-17 sont les derniers agents biologiques à avoir reçu une indication pour le traitement des SpA, le sécukinumab étant maintenant indiqué pour la SA et le RP et l’ixékizumab, pour le RP (Tableau 1). La poursuite de la recherche avec ces agents et d’autres agents fournira vraisemblablement aux cliniciens et à leurs patients d’autres options efficaces pour traiter ces maladies courantes, mais invalidantes.
Le congrès scientifique de l’European League Against Rheumatism (EULAR) est l’un des événements annuels les plus importants dans le domaine de la rhumatologie. L’événement de cette année, qui a eu lieu à Amsterdam du 13 au 16 juin, présentait quantité de nouvelles recherches sur une panoplie diversifiée de maladies rhumatologiques. Le présent rapport résume les principaux points saillants des nouvelles recherches en matière de SpA présentées à l’édition 2018 du congrès de l’EULAR, avec une attention particulière sur la SA et le RP. Il comprend un certain nombre d’analyses examinant les nouveaux traitements biologiques (p. ex. anti-IL-17 et anti-IL-23p19), ainsi que plusieurs autres, enrichissant notre compréhension de l’utilisation optimale des traitements existants (p. ex. agents anti-TNF). Outre les mesures traditionnelles de l’efficacité, les chercheurs évaluent également, et font état, d’autres résultats importants, y compris la progression radiographique de la maladie, les manifestations extra-articulaires (MEA) secondaires et la qualité de vie (QdV).
Outre les résumés des études clés présentées au congrès de l’EULAR, ce document inclut également les commentaires d’experts, rédigés par les docteurs Vinod Chandran et Cathy Flanagan, qui présentent leurs interprétations des études et de leurs répercussions potentielles dans la pratique clinique canadienne.
Mise à jour sur le traitement de la spondylarthrite ankylosante (SA)
Approche thérapeutique de la SA axée sur les valeurs cibles
Le concept de « traitement aux valeurs cibles », largement accepté dans la polyarthrite rhumatoïde (PR)18, est de plus en plus prôné également dans les SpA19. Des preuves supplémentaires à l’appui de cette approche ont a été présentées au congrès 2018 de l’EULAR. Le rhumatologue canadien Dr Walter Maksymowych a présenté une analyse des données de deux cohortes atteintes de SA, montrant qu’une rémission soutenue de la maladie inflammatoire est associée à une progression radiographique moindre au fil du temps20. L’étude a inclus 237 patients atteints de SpA axiales (SpAax) au stade précoce, plus précisément 161 patients provenant de l’étude clinique EMBARK sur l’étanercept et 76 patients provenant de la cohorte DESIR n’ayant jamais reçu de traitement biologique. Dans chaque groupe, les patients dont la maladie montrait une inactivité soutenue (score d’activité de la spondylarthrite ankylosante ASDAS [Ankylosing Spondylitis Disease Activity Score] < 1,3) présentaient un risque significativement inférieur de progression radiographique de la maladie que les patients sans rémission soutenue.
Nouvelles recherches sur les agents anti-IL-17
Sécukinumab (anti-IL-17A)
4 ans du sécukinumab, avec de bons taux de rétention, et ce, sans apparition de nouveaux problèmes d’innocuité23,24.
L’efficacité et l’innocuité du sécukinumab dans le traitement de la SA ont été démontrées précédemment dans les études MEASURE-1, -2 et
-321,22, au cours desquelles le sécukinumab à 150 mg a démontré des améliorations significatives des signes et symptômes de la SA chez les sujets n’ayant jamais reçu d’anti-TNF ou ayant présenté une réponse inadéquate (RI) aux anti-TNF par rapport au placebo6,7, et ce, avec ou sans dose d’attaque intraveineuse (IV) (10 mg/kg)21,22. Dans l’étude MEASURE-3, la dose d’entretien de 300 mg s’est également révélée efficace, et aucun effet supplémentaire sur le plan de l’innocuité n’a été signalé. Au Canada, la dose actuellement recommandée est celle de 150 mg, administrée par injection sous-cutanée, d’abord les semaines 0, 1, 2, 3 et 4, puis mensuellement en guise d’entretien17.
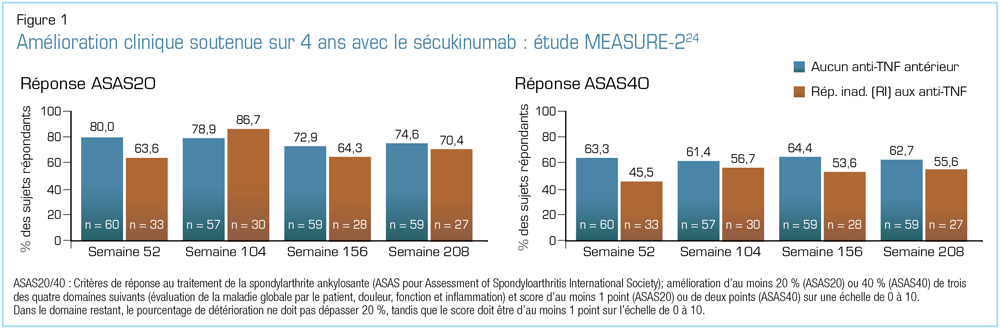
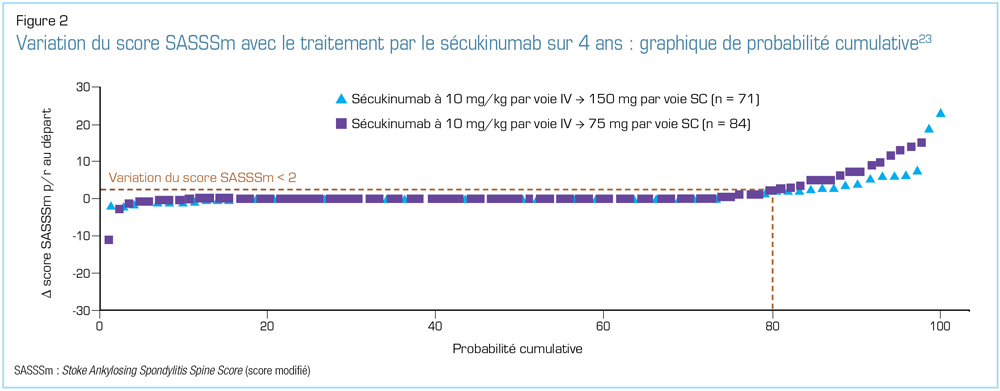
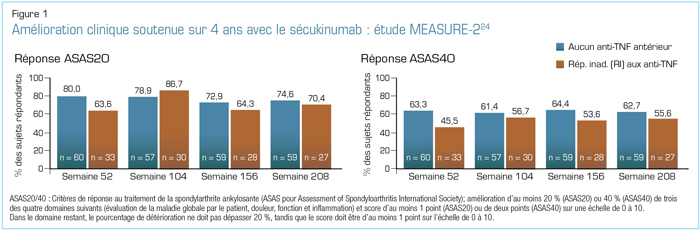
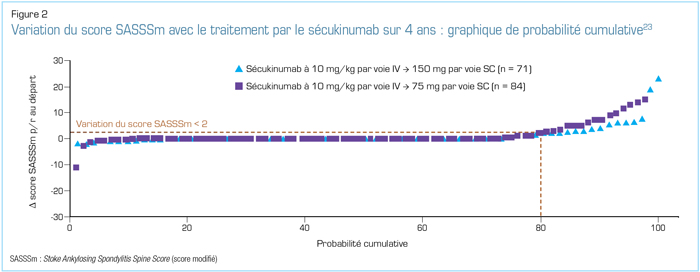
Lors du congrès 2018 de l’EULAR, plusieurs analyses des données des études MEASURE ont été présentées. En ce qui concerne les résultats relatifs à l’efficacité et à l’innocuité tirés du suivi à long terme, les chercheurs des deux études MEASURE-1 et -2 ont présenté des données sur une période de suivi allant jusqu’à 4 ans23. L’étude MEASURE-2 révèle l’efficacité soutenue jusqu’à 4 ans du sécukinumab, avec de bons taux de rétention, et ce, sans apparition de nouveaux problèmes d’innocuité23,24. Pour ce qui est des signes et symptômes cliniques, l’analyse à 4 ans des données de l’étude MEASURE-2 a révélé des proportions semblables de patients maintenant des réponses ASAS20 et ASAS40 au cours de ces 4 années, tant chez les sujets jamais traités par un anti-TNF que chez ceux n’ayant pas répondu adéquatement aux anti-TNF ou ne les ayant pas tolérés (Figure 1)24. Les analyses de l’étude MEASURE-1 comprenaient une évaluation de la progression radiographique23. Comme l’illustre la Figure 2, les patients traités avec du sécukinumab ont montré de faibles taux de progression radiographique ainsi qu’une efficacité clinique soutenue au cours des 4 années de cette étude23. Les seuls facteurs prédictifs significatifs de progression radiographique future au départ étaient le sexe masculin, la présence de syndesmophytes et un taux de protéine C réactive (CRP) élevé23.
Un autre groupe de chercheurs a comparé les résultats radiographiques de l’étude MEASURE-1 associés au sécukinumab à ceux d’une cohorte historique de patients atteints de SA n’ayant pas reçu de médicament biologique (cohorte de l’étude ENRADAS)25. Ils ont constaté que, dans l’ensemble, les taux de progression radiographique étaient faibles dans chaque cohorte et que le sécukinumab était associé à un taux numériquement plus faible de progression radiographique, bien qu’aucune de ces comparaisons n’ait montré une signification statistique25.
De plus, concernant l’analyse des sous-groupes, à l’aide des données regroupées provenant des études MEASURE-1 et -2, les chercheurs ont démontré un effet significatif et constant du traitement par le sécukinumab par rapport au placebo, indépendamment du taux initial de CRP, bien que l’effet thérapeutique était plus important chez les sujets présentant un taux de CRP initial plus élevé26.
L’incidence des affections concomitantes est un autre domaine d’étude important avec les agents anti-IL-17. Une des affections particulièrement au centre de l’attention du congrès était l’uvéite. Lors du congrès 2017 de l’EULAR, les chercheurs ont présenté une analyse de la base de données des études cliniques sur le sécukinumab, laquelle a montré une faible incidence globale d’uvéites, celles-ci touchant un total de 3,3 % (26/794) des patients traités par du sécukinumab dans tous les essais27. Parmi ces cas d’uvéite, 12 étaient de nouveaux cas et 14 étaient des récidives, se traduisant en une incidence de 1,4 cas pour 100 années-patients. Ces résultats étaient rassurants puisqu’ils venaient quelque peu contredire une autre recherche ayant démontré une prévalence globale d’uvéites d’environ 33 % chez les patients atteints de SA28 et un taux d’incidence entre 2,6 et 3,5 cas pour 100 années-patients chez les patients traités par des agents anti-TNF29-32. Dans le même rapport, les experts cliniques ont fait état de l’incidence des uvéites après la commercialisation du produit : 0,03 cas pour 100 années-patients sur plus de 96 000 années-patients de traitement27.
Fait également important, l’analyse des études de phase III du sécukinumab dans le traitement du RP et de la SA a montré que cet agent est associé à une très faible immunogénicité33.
Agents anti-IL-17 expérimentaux contre la SA
Outre la recherche présentée sur le sécukinumab, le programme du congrès 2018 de l’EULAR comprenait également la présentation de certaines données d’étude de phase II de détermination de la dose portant sur d’autres agents anti-IL-17. Le bimékizumab, un nouvel inhibiteur de l’IL-17A et -F, et le BCD-085, un inhibiteur de l’IL-17A, ont démontré une efficacité clinique prometteuse aux semaines 12 et 16, respectivement34,35.
Ni l’ixékizumab ni le brodalumab, d’autres agents anti-IL-17, n’ont fait l’objet d’une présentation de données sur la SA au congrès 2018 de l’EULAR.
Nouvelles recherches sur les agents anti-TNF
Même si les agents anti-TNF sont utilisés depuis de nombreuses années dans le traitement de la SA, la recherche sur ces agents continue de s’affiner et de tendre vers une utilisation optimale contre cette maladie.
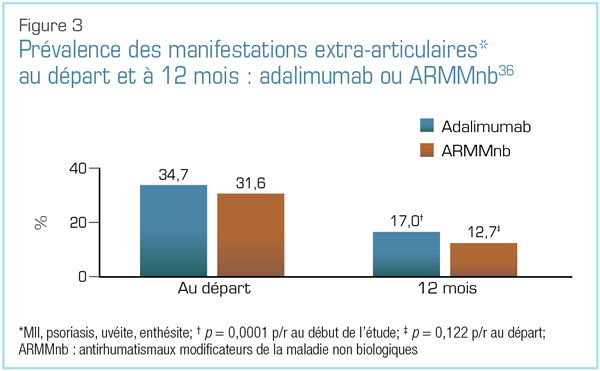
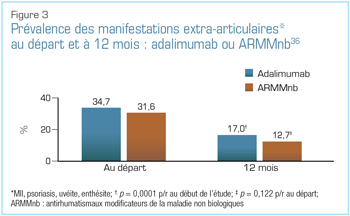
Au congrès 2018 de l’EULAR, l’une des observations les plus intéressantes liées à ces agents est provenue d’une étude post-commercialisation canadienne comparant l’adalimumab à des antirhumatismaux modificateurs de la maladie (ARMM) synthétiques classiques36. Comme l’illustre la Figure 3, les experts cliniques ont observé une plus grande régression des principales manifestations extra-articulaires (psoriasis, maladie inflammatoire de l’intestin [MII], uvéite ou enthésite) avec l’adalimumab qu’avec les ARMM non biologiques36. Il y avait également une différence significative dans les scores BASFI (Bath Ankylosing Spondylitis Functional Index) à 12 mois par rapport au début de l’étude en faveur de l’adalimumab, mais aucune différence significative dans les variations des scores BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) des composantes physique ou mentale du questionnaire abrégé sur l’état de santé à 12 points (Short Form Health Survey ou SF-12)36.
Une autre étude d’intérêt était l’analyse des 236 patients de la cohorte DESIR qui a démontré qu’une réponse antérieure aux anti-inflammatoires non stéroïdiens (AINS) n’était pas un facteur prédictif de réponse subséquente aux traitements anti-TNF37. Le taux de sujets répondants primaires aux AINS présentant une réponse BASDAI50 lors de leur premier traitement anti-TNF était de 32,5 % dans cette cohorte, tandis qu’il était de 23,5 % chez les sujets non-répondants primaires aux AINS (différence entre les groupes : p = 0,316)37 .
Les autres observations rapportées concernant les anti-TNF étaient que la progression radiographique semble se produire précocément chez les patients recevant un traitement anti-TNF prolongé38. Également, chez les patients qui présentent une rémission soutenue/faible activité de la maladie avec un traitement anti-TNF, la poursuite du traitement est associée à des résultats significativement supérieurs comparativement à l’arrêt de ce dernier39.
Autres recherches sur la SA
L’utilité diagnostique et pronostique de l’imagerie dans la SA était un domaine d’intérêt au congrès 2018 de l’EULAR. Une des études dans ce domaine a montré que parmi 802 volontaires en bonne santé âgés de moins de 45 ans, il y a une forte incidence d’œdème et de lésions graisseuses de la moelle osseuse à l’IRM au niveau de l’articulation sacro-iliaque (SI) et de la colonne vertébrale40. Une autre étude a plutôt révélé le manque de fiabilité de l’évaluation par IRM seule, montrant la présence d’oedème de la moelle osseuse, d’érosions et de lésions graisseuses dans les groupes sans SA avec et sans douleur, en particulier chez les femmes en post-partum41. Toutefois, d’autres experts cliniques ont rapporté que l’inflammation initiale observée à l’IRM au niveau de l’articulation SI est associée à des dommages structuraux sur 5 ans en présence d’une SpAax au stade précoce42.
Finalement, les experts cliniques d’un programme sur les SpAax, dirigé par une infirmière, ont montré que l’auto-prise en charge et l’auto-évaluation guidées par une infirmière étaient associées à des améliorations de la capacité d’adaptation, des scores BASDAI ainsi que de la fréquence et de la durée des exercices physiques chez les patients43.
Commentaire de l’expert
Dre Cathy Flanagan
Interprétation des nouvelles données sur la SA présentées au congrès 2018 de l’EULAR
Parmi les principaux sujets sur les SpA présentés au congrès de l’EULAR,
figuraient les concepts de traitement aux valeurs cibles, de la réduction graduelle des doses des agents biologiques, des diagnostics erronés fondés sur les examens d’IRM ainsi que des nouveaux agents biologiques. Le traitement aux valeurs cibles est bien accepté dans la PR, tandis que l’étude TICOPA menée sur le RP a montré de meilleurs résultats cliniques avec l’utilisation de cette approche. L’étude TICOSPA, qui se déroule actuellement, permettra également de savoir si l’approche de traitement aux valeurs cibles entraîne de meilleurs résultats chez les patients atteints de SpA. La mesure de résultat clinique la plus fréquemment utilisée est le score ASDAS, c’est pourquoi le Dr Maksymowych a examiné celui-ci dans deux cohortes; la première, EMBARK, un essai contrôlé à répartition aléatoire (ECRA) de 12 semaines évaluant l’étanercept dans le traitement des SpAax, suivi par une phase de prolongation ouverte de 96 semaines; et la deuxième, DESIR, une cohorte d’observation composée de patients atteints de SpA au stade précoce n’ayant jamais utilisé d’agents biologiques au cours d’une période de 2 ans. Les patients dans les deux groupes qui présentaient une maladie inactive soutenue selon le score ASDAS (< 1,3) montraient une diminution des érosions et une augmentation des tissus de comblement aux examens d’IRM, ce qui suggère une quantité moindre de dommages structuraux. Les données supplémentaires de la cohorte DESIR ont démontré que la présence d’une inflammation de la moelle osseuse locale était fortement associée à l’apparition de dommages structuraux sur une période de 5 ans dans les articulations SI et la colonne vertébrale en présence de SpA au stade précoce et était indépendante de l’inflammation systémique. Ces présentations suggèrent que le traitement aux valeurs cibles pourrait aider à améliorer non seulement les résultats cliniques, mais aussi radiographiques.
Le thème de la réduction graduelle de la dose est toujours pertinent. Les données de l’étude ABILITY-3 ont montré que les patients atteints de SpAax non radiographique ayant obtenu une rémission soutenue (selon le score ASDAS) avec l’adalimumab qui ont ensuite cessé de prendre celui-ci ont présenté un rapport de risque (RR) de récidive après l’arrêt du traitement de 1,77; lorsque les patients ont recommencé le traitement par l’adalimumab, après 12 semaines, seulement 57 % présentaient à nouveau une maladie inactive (selon le score ASDAS). De futures études avec réduction graduelle de la dose aux stades précoces de la maladie doivent être menées.
Bien qu’abordée depuis plusieurs années, la question des diagnostics erronés de SpA aux examens d’IRM a fait l’objet de quelques présentations lors de ce congrès de l’EULAR. Ces dernières ont montré que les sujets témoins en bonne santé, de même que les personnes souffrant de dorsalgie chronique, les coureurs et les femmes en post-partum souffrant de dorsalgie présentaient des résultats faussement positifs à l’IRM, le nombre le plus élevé étant observé chez les femmes en post-partum souffrant de dorsalgie. La présence de lésions oedémateuses profondes de la moelle osseuse selon le système de score du Spondyloarthritis Research Consortium of Canada (SPARCC) menait presque à un diagnostic de SpA, c’est pourquoi les examens d’IRM devraient être lus par des spécialistes en radiologie musculosquelettique. En ce qui concerne les nouveaux agents biologiques contre les SpA, deux essais de phase II ont été menés sur de nouveaux anti-IL-17, à savoir (1) le bimékizumab, un inhibiteur des IL-17A et -F, et (2) le BCD-085, un inhibiteur de l’IL-17A. Les deux agents se sont avérés efficaces et ont présenté un profil d’innocuité conforme à celui des autres inhibiteurs biologiques de l’IL-17, de sorte que les études de phase III sont en cours actuellement. Pour ce qui est du sécukinumab, les résultats de l’étude MEASURE-1 ont montré de faibles taux de progression radiographique et une efficacité clinique soutenue sur une période de
4 ans. Dans l’étude MEASURE-3, la dose de 300 mg du sécukinumab a été utilisée comme dose d’entretien sans apparition de nouveaux problèmes d’innocuité; malgré le fait que la dose indiquée du sécukinumab au Canada soit celle de 150 mg, la prise de 300 mg par mois semble être efficace et sûre.
Mise à jour sur le rhumatisme psoriasique (RP)
Nouvelles recherches sur les agents anti-IL-17
Sécukinumab
L’efficacité et l’innocuité du sécukinumab à 75, 150 ou 300 mg toutes les 4 semaines dans le traitement du RP ont été établies dans les études FUTURE-1 et -244,45. L’étude FUTURE-3 a corroboré ces résultats, cette fois-ci avec du sécukinumab à 150 ou 300 mg par rapport au placebo administré par les patients eux-mêmes à l’aide d’un auto-injecteur sous-cutané46. L’étude FUTURE-5 a démontré que les doses de 150 et de 300 mg étaient supérieures au placebo lorsqu’administrées avec ou sans dose d’attaque IV initiale47. L’étude FUTURE-4, qui n’a pas encore été publiée, évalue les doses de 150 et 300 mg administrées par auto-injecteur sous-cutané, avec ou sans dose d’attaque IV48.
Au Canada, le schéma posologique du sécukinumab actuellement recommandé pour le RP est la dose de 150 mg, administrée par injection sous-cutanée, d’abord les semaines 0, 1, 2, 3 et 4, puis mensuellement en guise d’entretien. Pour les patients ayant présenté une réponse inadéquate aux anti-TNF, la monographie de produit recommande d’envisager la dose de 300 mg du sécukinumab.
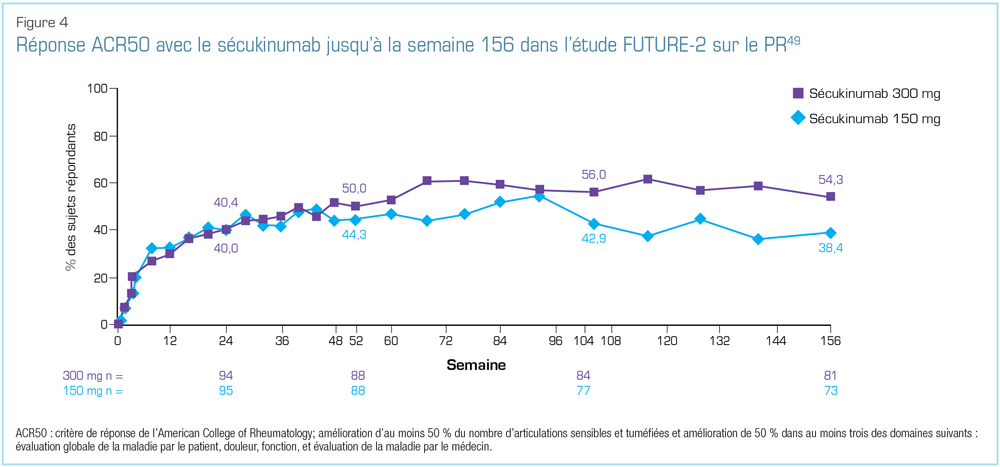
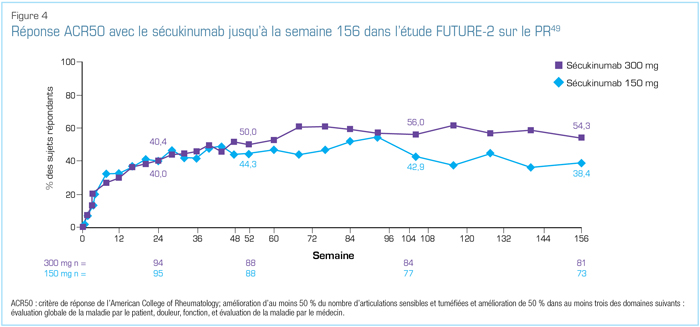
Lors du congrès 2018 de l’EULAR, plusieurs analyses des données des études FUTURE ont été présentées. Parmi celles-ci figurait l’analyse des données d’efficacité et d’innocuité sur 3 ans de l’étude FUTURE-249. Dans ce rapport, les experts cliniques ont fait état de taux soutenus de réponses ACR20 et ACR50 durant le suivi (Figure 4). Les résultats étaient constants chez les patients n’ayant jamais reçu d’anti-TNF ou n’y ayant pas répondu adéquatement, et ceux qui recevaient ou ne recevaient pas le méthotrexate49.
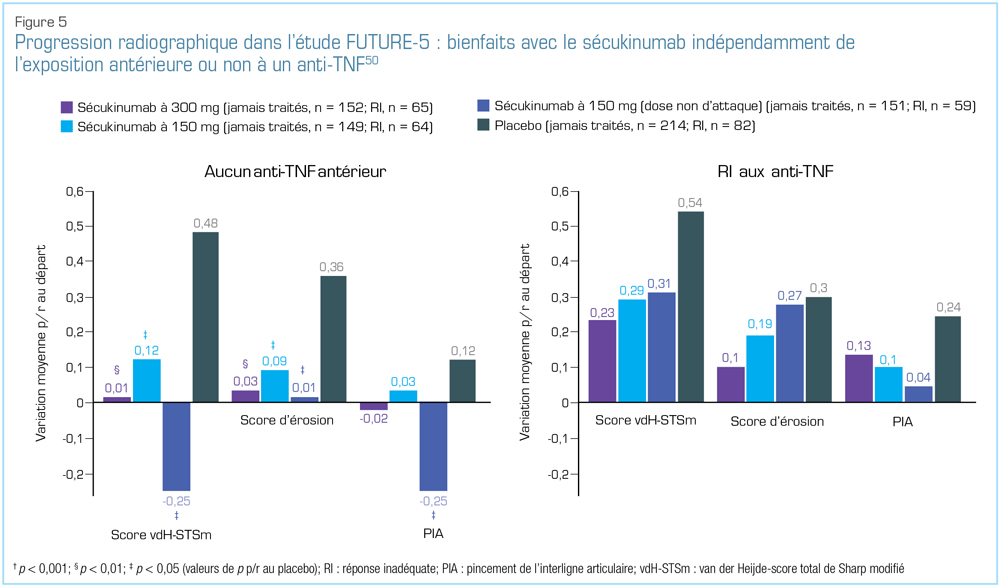
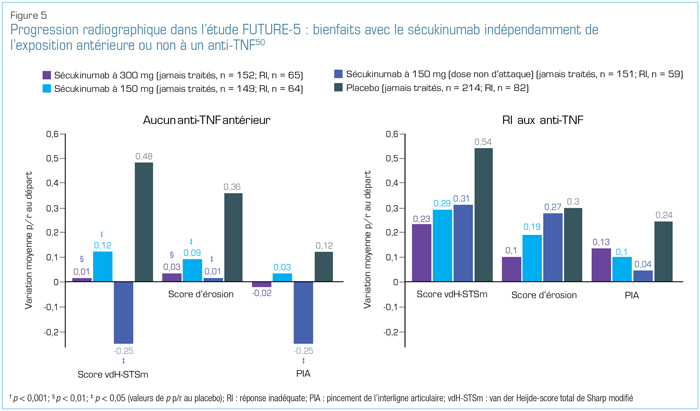
Les autres analyses de sous-groupe ont produit des résultats constants semblables. Dans le cadre d’une analyse de l’étude FUTURE-5, les chercheurs ont montré qu'une inhibition de la progression radiographique est survenue avec du sécukinumab, indépendamment de la prise antérieure d’un anti-TNF ou non, d’une réponse inadéquate aux anti-TNF ou non (Figure 5) ou de la prise antérieure de méthotrexate ou non50.
En ce qui concerne les manifestations importantes du RP, les données regroupées des études FUTURE-2 et -3 ont montré que le traitement par le sécukinumab a entraîné la résolution de l’enthésite chez la majorité des patients, même ceux présentant initialement une atteinte plus grave51 . Une analyse distincte, utilisant à nouveau les données regroupées des études FUTURE-2 et -3, a montré que le traitement par le sécukinumab était associé à une efficacité significativement plus élevée que le placebo peu importe la présence ou l’absence d’une enthésite initiale52 .
Outre ces observations relatives à l’efficacité, certains autres chercheurs ont présenté d’importantes données relatives à l’innocuité du sécukinumab dans le traitement du RP, notamment une analyse de tous les essais cliniques de phases II et III sur le RP ou le psoriasis, dans laquelle le sécukinumab a démontré un profil d’innocuité constant montrant de faibles taux de MII, de complications cardiovasculaires et d’autres événements indésirables graves53 .
Aussi, comme il est mentionné dans la section sur la SA plus haut, l’analyse des études de phase III sur le sécukinumab dans le traitement du RP et de la SA a montré que cet agent est associé à une très faible immunogénicité33.
Finalement, les observations initiales chez les femmes exposées accidentellement au sécukinumab pendant la grossesse ont également été présentées au congrès 2018 de l’EULAR54. Parmi les six rapports de cas, il n’y avait aucune indication claire de quelqu’effet néfaste que ce soit. Toutefois, en raison du manque de données, les auteurs mettent tout de même en garde d’éviter le sécukinumab pendant la grossesse, à moins que les bienfaits l’emportent clairement sur le risque potentiel54.
Ixékizumab
L’efficacité et l’innocuité de cet agent anti-IL-17 ont été établies dans les études SPIRIT menées chez des patients qui n’avaient jamais reçu d’anti-TNF (SPIRIT-P1) ou qui avaient présenté une réponse inadéquate (SPIRIT-P2)55,56.
Ces essais ont évalué l’ixékizumab à 80 mg administré toutes les 2 semaines ou toutes les 4 semaines par rapport au placebo. La dose recommandée pour le traitement du RP au Canada est de 160 mg par voie sous-cutanée (deux injections de 80 mg) à la semaine 0, suivie de 80 mg toutes
les 4 semaines16.
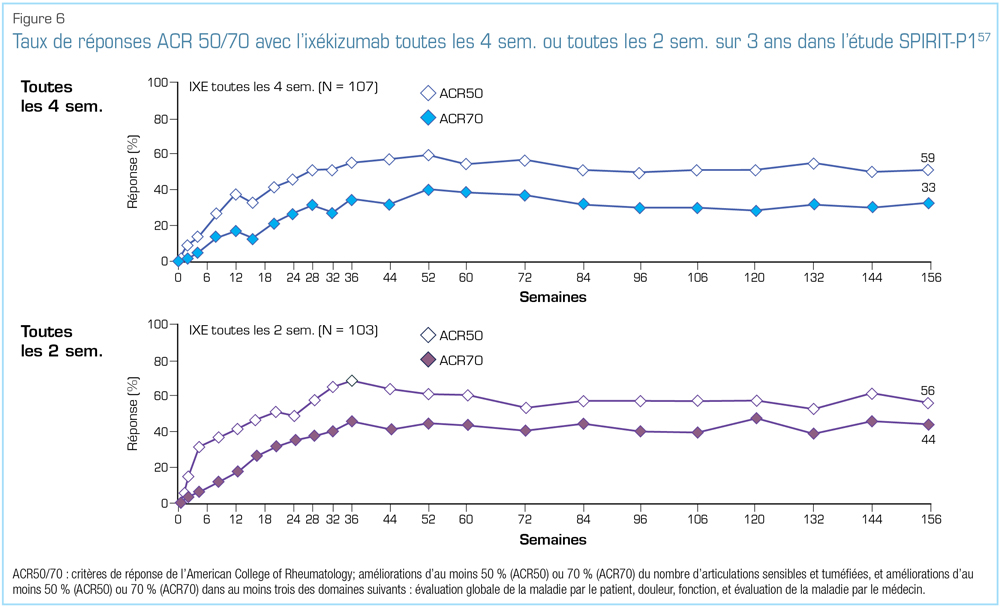
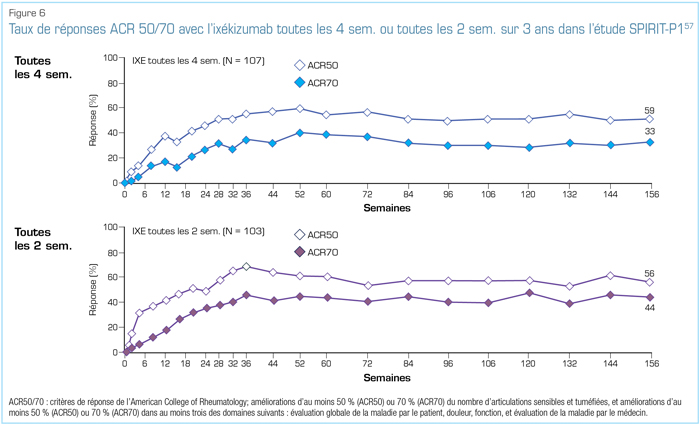
Lors du congrès 2018 de l’EULAR, quelques données supplémentaires importantes tirées d’essais pivots ont été présentées. Au cours du suivi à long terme de l’étude SPIRIT-P1 menée chez des patients n’ayant jamais reçu d’anti-TNF, le traitement par l’ixékizumab a été associé à une réponse clinique soutenue sur 3 ans (Figure 6)57
.
Les données de l’étude SPIRIT-P2 sont un peu plus récentes, mais les experts cliniques de cette étude ont tout de même présenté les données d’un an montrant une efficacité soutenue au cours de cette période58 .
Les données des études SPIRIT-P1 et -P2 ont été analysées afin de déterminer à quelle fréquence les patients traités par cet agent avaient présenté une faible activité de la maladie sur une période d’un an59. Un certain nombre de paramètres différents ont été utilisés. Les taux de faible activité de la maladie (d’après le score DAPSA [Disease Activity in Psoriatic Arthritis]) sur un an étaient de 31 % et de 29 % avec les schémas thérapeutiques aux 4 semaines et aux 2 semaines, respectivement, chez les patients n’ayant jamais reçu d’anti-TNF, et de 34 % et 26 % avec les schémas thérapeutiques aux 4 semaines et aux 2 semaines, respectivement, chez les patients n’ayant pas répondu adéquatement aux anti-TNF59.
En ce qui concerne les manifestations particulières, les experts cliniques ont analysé les atteintes des ongles et de la peau dans l’étude SPIRIT-P2, révélant que l’ixékizumab était associé à une résolution complète des lésions cutanées (PASI100) chez 40 % et 35 % des patients traités par les schémas thérapeutiques aux 4 semaines et aux 2 semaines, respectivement, ainsi qu’à une résolution complète des lésions unguéales (NAPSI0) chez 46 % des patients recevant le schéma aux 4 semaines et 32 % des patients recevant le schéma aux 2 semaines60.
Des évaluations distinctes ont montré des régressions significatives des enthésites et des dactylites dans des analyses regroupées de 52 semaines des essais SPIRIT-P1 et -P261.
Sur le plan de l’innocuité, une analyse regroupée des essais SPIRIT a été présentée, ne montrant aucun nouveau problème d’innocuité signalé avec cet agent chez les 1 118 patients sur une période de suivi de 1 373,4 années-patients62.
Nouvelles recherches sur les agents anti-IL-23p19
Cette classe d’agents biologiques s’est avérée prometteuse dans le traitement du psoriasis et du rhumatisme psoriasique. Le guselkumab, qui est indiqué pour le traitement du psoriasis en plaques au Canada63, est également en cours d’évaluation dans des essais cliniques de phase II sur le RP. Lors du congrès 2018 de l’EULAR, les résultats d’une telle étude de phase II ont été présentés. Parmi les 149 patients atteints de RP actif (≥ 3 articulations sensibles et ≥ 3 articulations tuméfiées, taux de CRP ≥ 3 mg/L) et de psoriasis actif (≥ 3 % de la surface corporelle), le guselkumab s’est avéré efficace, étant associé à des taux de réponses ACR20, 50 et 70 de 73,5 %, 53 % et 32,5 % à la semaine 5664 . Des présentations distinctes ont montré que ce traitement était efficace pour maîtriser tant les enthésites que les dactylites chez les patients présentant ces manifestations au départ65,66.
Le risankizumab est un autre agent de cette classe qui, bien que non approuvé au Canada pour l’instant, a également démontré une activité prometteuse au cours d’une étude de phase II sur le RP présentée au congrès 2018 de l’EULAR. Globalement, les taux d’ACR 20, 50 et 70 à la semaine 24 étaient de 48 %, 22 % et 13 % avec le risankizumab, et de 31 %, 7 % et 2 % avec le placebo67.
Nouvelles recherches sur les agents anti-TNF et les petites molécules
Peu de nouveaux renseignements sur l’utilisation des agents plus établis ont été présentés au congrès 2018 de l’EULAR. Toutefois, une étude intéressante a comparé les taux de survie liés à divers agents anti-TNF individuels (adalimumab, étanercept, golimumab et infliximab)68, laquelle a montré que le taux de survie globale lié aux médicaments était de 50 % sur 5 ans, et que l’infliximab était l’agent associé au taux de persistance le plus faible.
Quelques données rassurantes ont également été présentées sur l’apremilast, un inhibiteur de la phosphodiestérase 4 (PDE-4) à prise orale. Dans le cadre d’une analyse à long terme des études PALACE, les experts cliniques ont signalé que le traitement par l’apremilast était associé à des améliorations cliniquement significatives et soutenues des signes et symptômes du RP sur 5 ans69.
Quelques recherches présentées au congrès de l’EULAR ont apporté de nouvelles connaissances sur l’utilisation du tofacitinib, un inhibiteur de JAK (Janus kinase), dans le traitement du RP. Les chercheurs ont présenté une méta-analyse en réseau de 21 ECRA évaluant le tofacitinib, des agents biologiques ou l’apremilast dans le traitement du RP actif chez des patients n’ayant jamais reçu d’anti-TNF70. Des techniques bayésiennes ont été utilisées pour comparer les taux de réponse ACR20, de même que les variations dans les indices d’invalidité HAQ-DI (Health Assessement Questionnaire Disability Index), les scores de gravité des dactylites DSS (Dactylitis Severity Score) et les indices d’enthésite de Leeds LEI (Leeds Enthesitis Index) avec les différents traitements. Le tofacitinib à 5 mg 2 fois par jour et le tofacitinib à 10 mg 2 fois par jour se sont classés aux 14e et 9e rangs parmi les 18 comparateurs en ce qui concerne la réponse ACR20 et au 11e rang pour ce qui est des variations de l’indice HAQ-DI. Dans les deux études qui ont évalué les variations dans les scores DSS et LEI, il n’y a eu aucune différence substantielle entre le tofacitinib à 5 ou à 10 mg 2 fois par jour et l’adalimumab à 40 mg aux 2 semaines ou l’ixékizumab à 80 mg aux 2 semaines et aux 4 semaines70.
Les autres résultats sur le tofacitinib dans le traitement du RP présentés au congrès 2018 de l’EULAR comprenaient une analyse des données sur la douleur provenant d’études de phase II sur la PR et le RP et d’une étude de phase II sur la SA7171 . Dans tous ces ensembles de données, les deux doses du tofacitinib ont été associées à une atténuation rapide et une réduction soutenue de la douleur.
Finalement, certaines données rassurantes relatives à l’innocuité ont été présentées sur le tofacitinib dans le traitement du RP. Au cours d’un suivi de 3 ans d’un essai de prolongation à long terme (OPAL Balance), comprenant des patients de trois essais distincts de phase III, contrôlés et à répartition aléatoire, aucun nouveau problème d’innocuité n’a été relevé72. En outre, dans le cadre d’une évaluation de l’innocuité cardiovasculaire du traitement prolongé par le tofacitinib dans le RP, les experts cliniques ont signalé que l’ampleur et la corrélation avec la dose des augmentations des taux de lipides concordaient avec les résultats obtenus dans les études sur le tofacitinib chez les patients atteints de psoriasis et de PR73.
Autres recherches sur le traitement du RP
Quelques autres données intrigantes issues de la recherche sur le RP ont été présentées au congrès 2018 de l’EULAR. Un groupe de chercheurs provenant de Hong Kong ont évalué les répercussions de l’activité du RP sur les marqueurs d’athérosclérose subclinique74. Ils ont découvert chez les patients ayant obtenu une activité minimale de la maladie au cours de la première année du traitement, puis ayant maintenue celle-ci pendant une autre année, la présence de certains bienfaits sur l’épaisseur intimamédia moyenne de la carotide et de la rigidité artérielle74.
Dans une autre étude qui pourrait servir de guide aux décisions thérapeutiques dans l’avenir, les experts cliniques ont évalué 24 patients atteints de RP en analysant leurs lymphocytes périphériques au moyen d’une cytométrie de flux75. Le but était de sélectionner l’agent biologique optimal pour le traitement (groupe de traitement stratégique) en fonction du profil des lymphocytes T auxiliaires des individus. Un autre groupe de 38 patients ont été traités de façon empirique au moyen d’un agent biologique standard selon les recommandations de l’EULAR. Chez les patients du groupe stratégique, une faible activité du RP a été obtenue chez 92,3 % des patients (24/26). Ce résultat était significativement plus élevé que celui observé chez les 21 patients sur 38 (55,2 %) ayant obtenu une faible activité de la maladie dans le groupe de traitement biologique standard75.
Commentaire de l’expert
Dr Vinod Chandran
Interprétation des nouvelles données sur le RP présentées au congrès 2018 de l’EULAR
Les projets continus de recherche et leurs énormes répercussions
sur la pratique clinique dans le traitement du RP ont été à l’avant-plan
du congrès 2018 de l’EULAR. Même si les traitements anti-TNF ont
révolutionné les soins administrés aux patients atteints de RP au cours
des 10 dernières années, nombreux sont ceux qui ne répondent toujours
pas aux inhibiteurs du TNF ou qui présentent un échec secondaire ou
diverses contre-indications à ceux-ci. Une meilleure compréhension du
rôle de l’axe TH-17 a mené à la mise au point de médicaments ciblant
diverses cytokines clés de cet axe, notamment l’IL-17 et l’IL-23. Le
sécukinumab et, maintenant, l’ixékizumab montrent une efficacité à court
terme éprouvée dans le traitement du psoriasis et du RP. Lors du congrès
de l’EULAR, les données relatives à l’efficacité et à l’innocuité à long terme
ont été présentées, consolidant d’autant plus leur rôle dans la prise en
charge des patients atteints de RP, jamais et déjà traités par des agents
biologiques. Aucun nouveau problème d’innocuité n’a été observé. Il a
aussi été démontré dans les études de phase II que les inhibiteurs de
l’IL-23 sont également efficaces dans les divers domaines du RP. Les
résultats des essais de phase III sont attendus avec impatience. Les
petites molécules comme le tofacitinib, un inhibiteur de JAK, offrent une
grande facilité d’administration. Les données présentées au congrès de
l’EULAR font état de l’innocuité et de l’efficacité du tofacitinib chez les
patients jamais traités comme chez ceux déjà traités, faisant du produit
un ajout apprécié à nos options de traitement.
Avec les nombreuses options thérapeutiques bientôt disponibles pour la prise en charge du RP, la sélection du traitement fondée sur les biomarqueurs pourrait devenir réalité. Toutefois, la recherche en médecine de précision en est encore à ses premiers balbutiements. L’étude fondée sur le phénotypage des cellules sanguines périphériques a servi de validation de principe et nécessitera une vérification et une validation supplémentaires.
Les maladies concomitantes influent de façon significative sur la réponse au traitement dans le RP. En outre, une plus grande maîtrise de la maladie entraînera vraisemblablement moins de maladies concomitantes, en particulier des maladies cardiovasculaires (MCV). Lors du congrès de l’EULAR, il a été démontré que les régimes alimentaires extrêmes peuvent provoquer une perte de poids significative et une augmentation de l’activité de la maladie. En outre, l’obtention d’une activité minimale et soutenue de la maladie a été associée à de meilleurs résultats sur le plan des indicateurs de substitution des MCV.
Ainsi, les études rapportées au congrès 2018 de l’EULAR fournissent aux praticiens en rhumatologie une plus grande confiance à l’égard des médicaments actuellement disponibles pour le traitement du RP, de même que des données préliminaires sur les nouveaux traitements; elles renforcent également la nécessité de la prise en charge des maladies concomitantes et fournissent un aperçu des promesses offertes par la médecine de précision.
Références :
- Association canadienne de spondylarthrite. Faits et chiffres. Disponible à l'adresse : www.spondylitis.ca/. Consulté en juillet 2018.
- Société de l'arthrite. Spondylarthrite ankylosante. Disponible à l'adresse : arthritis.ca/. Consulté en juillet 2018.
- Corporation AbbVie. Monographie d'Humira® Date d'approbation : 26 mars 2018.
- Samsung Bioepis. Monographie d'Hadlima™ Date d'approbation : 8 mai 2018.
- UCB Canada Inc. Monographie de Cimzia®. Date d'approbation : 18 avril 2018.
- Immunex Corporation. Monographie d'EnbrelMD. Date d'approbation : 13 avril 2018.
- Samsung Bioepis. Monographie de Brenzys™. Date d'approbation : 18 juin 2018.
- Sandoz Canada Inc. Monographie d'ErelziMC. Date d'approbation : 6 avril 2017.
- Janssen Inc. Monographie de Simponi®. Date d'autorisation : 4 juin 2018.
- Janssen Inc. Monographie de Remicade®. Date d'autorisation : 15 mai 2018.
- Celltrion Healthcare Co., Ltd. Monographie de RemsimaMC. Date d'approbation : 5 août 2016.
- Celltrion Healthcare Co., Ltd. Monographie d'InflectraMD. Date d'approbation : 7 novembre 2017.
- Samsung Bioepis. Monographie de RenflexisMC. Date d'approbation : 1er décembre 2017.
- Bristol-Myers Squibb. Monographie d'OrenciaMD. Date d'approbation : 15 mars 2018.
- Janssen Inc. Monographie de Stelara® Date d'autorisation : 8 mars 2018.
- Eli Lilly Canada Inc. Monographie de TaltzMC. Date d'approbation : 29 mars 2018.
- Novartis Pharmaceutiques Canada inc. Monographie de CosentyxMD. Date d'approbation : 16 mai 2018.
- Smolen JS, Breedveld FC, Burmester GR, et coll. Treating rheumatoid arthritis to target: 2014 update of the recommendations of an international task force. Ann Rheum Dis 2016; 75(1):3-15.
- Smolen JS, Schöls M, Braun J, et coll. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis 2018; 77(1):3-17.
- Maksymowych W, et coll. Sustained remission of inflammation is associated with reduced structural damage on sacroiliac joint magnetic resonance imaging in patients with early axial spondyloarthritis: Evidence to support the concept of treat-to-target. Présenté à l'EULAR 2018; présentation no OP0199.
- Baeten D, Sieper J, Braun J, et coll. Secukinumab, an interleukin-17A inhibitor, in ankylosing spondylitis. N Engl J Med 2015; 373(26):2534-48.
- Pavelka K, Kivitz A, Dokoupilova E, et coll. Efficacy, safety, and tolerability of secukinumab in patients with active ankylosing spondylitis: a randomized, double-blind phase 3 study, MEASURE 3. Arthritis Res Ther 2017; 19(1):285.
- Baraliakos X, et coll. Secukinumab demonstrates low radiographic progression and sustained efficacy through 4 Years in patients with active ankylosing spondylitis. Présenté à l'EULAR 2018; affiche no SAT0268.
- Marzo-Ortega H, et coll. Secukinumab 150 mg provides sustained improvements in the signs and symptoms of active ankylosing spondylitis with high retention rate: 4-year results from the phase III trial, MEASURE 2. Présenté à l'EULAR 2018; affiche no SAT0283.
- Braun J, et coll. Low rate of spinal radiographic progression over 2 years in ankylosing spondylitis patients treated with secukinumab: a historical cohort comparison. Présenté à l'EULAR 2018; affiche no SAT0259.
- Braun J, et coll. Secukinumab demonstrates rapid and sustained efficacy in ankylosing spondylitis patients with normal or elevated baseline CRP levels: pooled analysis of two phase 3 studies. Présenté à l'EULAR 2018; affiche no SAT0288.
- Deodhar A, et coll. Low incidence of both new-onset and flares of uveitis in secukinumab-treated patients with ankylosing spondylitis: clinical trial and post-marketing safety analysis. Présenté à l'EULAR 2018; affiche no SAT0270.
- Zeboulon N, Dougados M, Gossec L. Prevalence and characteristics of uveitis in the spondyloarthropathies: a systematic literature review. Ann Rheum Dis 2008; 67(7):955-9.
- Wendling D, Joshi A, Reilly P, et coll. Comparing the risk of developing uveitis in patients initiating anti-tumor necrosis factor therapy for ankylosing spondylitis: an analysis of a large US claims database. Curr Med Res Opin 2014; 30(12):2515-21.
- van der Heijde D, Dougados M, Landewé R, et coll. Sustained efficacy, safety and patient-reported outcomes of certolizumab pegol in axial spondyloarthritis: 4-year outcomes from RAPID-axSpA. Rheumatology (Oxford) 2017; 56(9):1498-509.
- Sieper J, van der Heijde D, Varothai NA, et coll. Comparison of baseline extra-articular manifestations, comorbidities, and long-term safety in patients treated with adalimumab for ankylosing spondylitis and non-radiographic axial spondyloarthritis. Arthritis Rheum 2014; 66(s10):S242.
- Heldmann F, Brandt J, van der Horst-Bruinsma IE, et coll. The European ankylosing spondylitis infliximab cohort (EASIC): a European multicentre study of long-term outcomes in patients with ankylosing spondylitis treated with infliximab.Clin Exp Rheumatol 2011; 29(4):672-80.
- Deodhar A, et coll. Secukinumab, a fully human anti-interleukin-17A monoclonal antibody, exhibits low immunogenicity in patients with psoriatic arthritis and ankylosing spondylitis during a 52-week treatment period. Presented at EULAR 2018; Poster #SAT0271.
- van der Heijde D, et coll. Dual neutralisation of IL-17A and IL-17F with bimekizumab in patients with active ankylosing spondylitis: 12-week results from a Phase 2b, randomised, double-blind, placebo-controlled, dose-ranging study. Presented at EULAR 2018; Presentation #LB0001.
- Dubinina T, et coll. Efficacy and safety of BCD-085, a novel IL-17 inhibitor, in ankylosing spondylitis. Results of phase 2 clinical study. Présenté à l'EULAR 2018; présentation no OP0028.
- Bessette L, et coll. Canadian adalimumab post-marketing observational epidemiological study assessing the effectiveness of adalimumab vs. non-biologic DMARDs in ankylosing spondylitis (COMPLETE-AS): 12-month effectiveness data. Presented at EULAR 2018; Poster #SAT0290.
- Couvaras L, et coll. Is a primary good response to NSAIDs predictive of the subsequent response to the first TNF inhibitor in patients with recent axial spondyloarthritis? Présenté à l'EULAR 2018; présentation no OP0022.
- Rios Rodriguez V, et coll. Identification of predictors of structural damage progression in the sacroiliac joints in patients with early axial spondyloarthritis on a long-term anti-TNF treatment. Presented at EULAR 2018; Presentation #OP0025.
- Landewe R, et coll. Efficacy and safety of continuing versus withdrawing adalimumab in maintaining remission in patients with nonradiographic axial spondyloarthritis. Présenté à l'EULAR 2018; présentation no OP0334.
- Baraliakos X, et coll. Prevalence of inflammatory and chronic changes suggestive of axial spondyloarthritis in magnetic resonance images of the axial skeleton in individuals < 45 years in the general population as part of a large community study (SHIP). Présenté à l'EULAR 2018; présentation no OP0243.
- Seven S, et coll. Ability of MRI of the sacroiliac joints to differentiate patients with axial spondyloarthritis from women who have given birth, patients with disc herniation, persons with hard physical work, long-distance runners and healthy males. Présenté à l'EULAR 2018; présentation no OP0245.
- Sepriano A, et coll. Inflammation on MRI of spine and sacroiliac joints is highly predictive of structural damage in axial spondyloarthritis: The 5 years data of the DESIR cohort. Présenté à l'EULAR 2018; présentation no OP0246.
- Molto A, et coll. Impact of a nurse-led program of patient self-assessment and self-management axial spondyloarthritis: Results of a prospective, multicentre, randomized, controlled trial (COMEDSPA). Presented at EULAR 2018; Presentation #OP0164-PR.
- Mease PJ, McInnes IB, Kirkham B, et coll. Secukinumab inhibition of interleukin-17A in patients with psoriatic arthritis. N Engl J Med 2015; 373(14):1329-39.
- McInnes IB, Mease PJ, Kirkham B, et coll. Secukinumab, a human anti-interleukin-17A monoclonal antibody, in patients with psoriatic arthritis (FUTURE 2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet 2015; 386(9999):1137-46.
- Nash P, Mease PJ, McInnes IB, et coll. Efficacy and safety of secukinumab administration by autoinjector in patients with psoriatic arthritis: results from a randomized, placebo-controlled trial (FUTURE 3). Arthritis Res Ther 2018; 20(1):47.
- Mease P, van der Heijde D, Landewé R, et coll. Secukinumab improves active psoriatic arthritis symptoms and inhibits radiographic progression: primary results from the randomised, double-blind, phase III FUTURE 5 study. Ann Rheum Dis 2018; 77(6):890-7.
- Clinicaltrials.gov. 16-week efficacy and 2-year safety, tolerability and efficacy of secukinumab in participants with active psoriatic arthritis (FUTURE 4). ClinicalTrials.gov Identifier: NCT02294227.
- Nash P, et coll. Secukinumab provides sustained improvements in the signs and symptoms of active psoriatic arthritis: 3-year results from the phase 3 FUTURE 2 study. Présenté à l'EULAR 2018; affiche no SAT0290.
- van der Heijde D, et coll. Subcutaneous secukinumab inhibits radiographic progression in psoriatic arthritis: analysis by prior anti-TNF therapy and concomitant methotrexate use. Présenté à l'EULAR 2018; présentation no OP0306.
- Coates LC, et coll. Secukinumab provides rapid and sustained resolution of enthesitis in psoriatic arthritis patients: pooled analysis of two phase 3 Studies, FUTURE 2 and FUTURE 3. Présenté à l'EULAR 2018; affiche no SAT0335.
- Wallman JK, et coll. Impact of secukinumab treatment on psoriatic arthritis patients with or without enthesitis at baseline: pooled data from two phase 3 studies (FUTURE 2 and FUTURE 3). Présenté à l'EULAR 2018; affiche no THU0311.
- Mease PJ, et coll. Secukinumab demonstrates a consistent safety profile with up to 5 years treatment in patients with psoriatic arthritis and moderate to severe plaque psoriasis: updated pooled safety analyses. Presented at EULAR 2018; Poster #THU0325.
- Meroni M, et coll. Overall safety of 7-week secukinumab exposure during pregnancy in women with psoriatic arthritis. Présenté à l'EULAR 2018; affiche no THU0319.
- Mease PJ, van der Heijde D, Ritchlin CT, et coll. Ixekizumab, an interleukin-17A specific monoclonal antibody, for the treatment of biologic-naive patients with active psoriatic arthritis: results from the 24-week randomised, double-blind, placebo-controlled and active (adalimumab)-controlled period of the phase III trial SPIRIT-P1. Ann Rheum Dis 2017; 76(1):79-87.
- Nash P, Kirkham B, Okada M, et coll. Ixekizumab for the treatment of patients with active psoriatic arthritis and an inadequate response to tumour necrosis factor inhibitors: results from the 24-week randomised, double-blind, placebo-controlled period of the SPIRIT-P2 phase 3 trial. Lancet 2017; 389(10086):2317-27.
- Chandran V, et coll. Efficacy and safety of ixekizumab in patients with active psoriatic arthritis: three year results from a phase 3 study (SPIRIT-P1). Présenté à l'EULAR 2018; affiche no THU0333.
- Genovese M, et coll. Efficacy and safety of ixekizumab in patients with active psoriatic arthritis and previous inadequate response to TNF Inhibitors: 52-week results from a phase 3 Study. Présenté à l'EULAR 2018; affiche no SAT0341.
- Coates LC, et coll. Ixekizumab makes very low disease activity and remission with psoriatic arthritis disease activity score possible in active psoriatic arthritis patients for up to 1 year: SPIRIT-P1 and SPIRIT-P2 trials. Presented at EULAR 2018; Poster #THU0314.
- Merola JF, et coll. Ixekizumab improves nail and skin lesions through 52 weeks in patients with active psoriatic arthritis and inadequate response to tumor necrosis factor inhibitors. Présenté à l'EULAR 2018; affiche no THU0313.
- Gladman DD, et coll. Ixekizumab treatment significantly improves enthesitis and dactylitis in patients with active psoriatic arthritis: results from the SPIRIT trials. Présenté à l'EULAR 2018; affiche no SAT0321.
- Goupille P, et coll. Safety of ixekizumab in patients with psoriatic arthritis: results from a pooled analysis of three clinical trials. Présenté à l'EULAR 2018; affiche no SAT0348.
- Janssen Inc. Tremfya™ Product Monograph. Date of Authorization: November 10, 2017.
- Deodhar A, et coll. Efficacy and safety results of guselkumab in patients with active psoriatic arthritis over 56 weeks from a phase 2A, randomized, double-blind, placebo-controlled study. Presented at EULAR 2018; Presentation #OP0308.
- Gladman DD, et coll. The effect of guselkumab on dactylitis: Results from a phase 2 study with active psoriatic arthritis. Présenté à l'EULAR 2018; affiche no SAT0322.
- Helliwell P, et coll. The effect of guselkumab on enthesitis: Results from a phase 2 study with active psoriatic arthritis. Présenté à l'EULAR 2018; affiche no SAT0344.
- Mease PJ, et coll. Efficacy and safety of risankizumab, a selective IL-23p19 inhibitor, in patients with active psoriatic arthritis over 24 weeks: Results from a phase 2 trial. Présenté à l'EULAR 2018; présentation no OP0307.
- García-Porrúa C, et coll. Drug survival on first TNF inhibitors in patients with psoriatic arthritis. Comparison across etanercept, adalimumab, golimumab and infliximab. Présenté à l'EULAR 2018; affiche no SAT0333.
- Kavanaugh A, et coll. 5-Year Efficacy and safety of apremilast treatment in subjects with psoriatic arthritis: pooled analysis of the PALACE Studies. Présenté à l'EULAR 2018; affiche no THU0294.
- Gladman DD, Orbai A-M, Gomez-Reino J, et coll. Network meta-analysis of tofacitinib vs bdmards or apremilast for the treatment of TNF inhibitor-naÏve patients with psoriatic arthritis. Présenté à l'EULAR 2018; affiche no THU0300.
- Ogdie A, de Vlam K, McInnes IB, et coll. Effect of tofacitinib on reducing pain in patients with rheumatoid arthritis, psoriatic arthritis and ankylosing spondylitis. Présenté à l'EULAR 2018; affiche no SAT0221.
- Nash P, Coates LC, Kivitz AJ, et coll. Safety and efficacy of tofacitinib, an oral janus kinase inhibitor, up to 36 months in patients with active psoriatic arthritis: data from the third interim analysis of opal balance, an open-label, long-term extension study. Présenté à l'EULAR 2018; affiche no SAT0293.
- Gladman DD, Schoeman CC, McInnes IB, et coll. An integrated analysis of changes in lipid levels and incidence of cardiovascular events following tofacitinib treatment in patients with psoriatic arthritis across phase 3 and long-term extension studies. Présenté à l'EULAR 2018; affiche no THU0299.
- Cheng TH, et coll. Can achieving minimal disease activity (MDA) prevent progression of subclinical atherosclerosis and arterial stiffness? A two-year prospective cohort study in psoriatic arthritis. Presented at EULAR 2018; Presentation #OP0127.
- Miyagawa I, et coll. Precision medicine using different biological DMARDs based on characteristic phenotypes of peripheral T helper cells in psoriatic arthritis. Présenté à l'EULAR 2018; présentation no OP0321.
© STA HealthCare Communications inc., 2018. Tous droits réservés. Ce rapport a été rendu possible grâce au soutien de Novartis Pharma Canada inc. Les opinions et les renseignements contenus dans le présent document proviennent des auteurs et ne reflètent pas nécessairement les points de vue et opinions de Novartis Pharma Canada inc. ou de STA HealthCare Communications inc. Tout produit mentionné dans le présent document doit être utilisé conformément à l’information posologique contenue dans la monographie du produit.